製薬企業の趨勢は新薬の研究・開発(治験)・営業にかかっています
医薬品は一製品あたりの製造原価が安く、製造業の中でも利益率が非常に高い産業です。画期的な新薬を開発できれば、世界市場で年間数千億円を売り上げることも決して不可能ではなく、一回り大きな企業へと成長が期待できます。
しかし、一つの新薬の開発には数百億円から数千億円という莫大な研究開発費が必要です。米国医師会が発行する「JAMA」誌に掲載された論文によれば、2008年〜2019年にアメリカで承認された新薬一剤当たりの研究開発費の平均は1,400億円でした。
日本を一例を挙げると、2022年に国内で初めて承認された新型コロナ治療薬「ゾコーバ(塩野義製薬)」は異例の短期間で開発されましたが、この一剤に950億円もの研究開発費を投じています。
ちなみに現在、世界で最も売れている医薬品は、アッヴィ社(アメリカ)が開発したヒュミラ(関節リウマチ治療薬)で、年間約3兆5000億円を売り上げています(2021年)。
製薬会社の研究開発費は、国内のほか主要産業と比べても非常に高い水準になっています。例えば、企業売上高に占める研究開発費の割合は、電気・電子・精密機器・自動車産業が5%前後であるのに対して、製薬業界は20%前後と突出しています。
医薬品産業の市場規模は全世界で約157兆円(2021年)。自動車産業の世界市場が64兆円なので、いかに巨大なマーケットなのかがわかります。グローバル市場で成長が期待できる新薬を開発できれば、巨額の研究開発費が霞むほどの大きな利益を得ることができますが、治験の最終段階で頓挫して開発中止というケースも珍しくなく、リスクも大きいのです。製薬会社の趨勢は新薬開発の成否にかかっているため、どの企業も新薬候補の研究開発を複数並行して行っています。
| 製薬企業の研究開発費ランキング(2021年) | |||
| 企業名(本社) | 研究開発費 (億ドル) |
売上高 (億ドル) |
売上高に占める 研究開発費の割合 |
| 1.ロシュ(スイス) | 162 | 687 | 24% | 2.ファイザー(米) | 138 | 820 | 17% |
| 3.メルク(米) | 126 | 487 | 25% |
| 4.ジョンソン&ジョンソン(米) | 119 | 521 | 23% |
| 5.ブリストル・マイヤーズ(米) | 114 | 464 | 25% |
| 6.アストラゼネカ(英) | 97 | 374 | 26% |
| 7.ノバルティス(スイス) | 95 | 516 | 18% |
| 8.グラクソ・スミスクライン(英) | 73 | 469 | 16% |
| 9.アッヴィ(米) | 71 | 562 | 13% |
| 10.イーライリリー(米) | 70 | 283 | 25% |
| 15.武田薬品工業(日) | 47 | 321 | 15% |
| 19.アステラス製薬(日) | 22 | 135 | 16% |
| 20.大塚ホールディングス(日) | 21 | 117 | 18% |
金額面だけでなく、開発に必要な期間も膨大です。新薬の研究開発プロジェクトを立ち上げてから、動物実験や人を対象とする臨床試験、規制当局による承認審査を経て、晴れて市場に出るまでの創薬期間は最低でも10年間は必要です。開発がスムーズに行かず手間取れば、20年近くかかることもあります。
他産業との決定的な違いは、開発成功に至るまでの「不確実性」というハードルが高いことにあります。人体に直接投与するという医薬品の特性上、試験管の中やマウスでの試験結果が良好でも、いざ人に使用してみると、予期しない副作用が発生したり、効き目が既存薬に及ばなかったりというケースは頻発します。
こういった様々なリスクが介在するため、新薬開発の成功率は、一つの医薬品の候補物質を発見してから22,407分の1(出典:製薬協「てきすとぶっく 製薬産業 2020-2021」より)となっています。
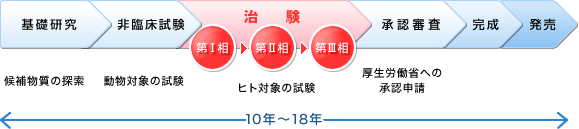
製薬会社における新薬開発の流れは、以下の「研究」「開発(治験)」「営業」に分けることができます。
新薬の研究
新薬の研究は、各研究者が設定された対象疾患に基づいて行います。研究者はまず、医薬品が疾患に対して作用するアプローチを決め、その作用を起こす物質(シーズ:種)を探します。
目的物質は1つではなく、近似した化合物もあわせると数百、数千個に上るので、最も効用が高いものをスクリーニングで選びだし、そこからさらに派生化合物を合成して、薬効と安全性などを分析・試験します。試験はラットやサル、イヌ、ウサギなどを使った「前臨床試験」で行い、基準をパスした物質が一定の審査を経て次の「治験」へと進みます。
新薬の開発(治験)
治験では、実際に被験薬を人に投与して、その有効性と安全性を確かめます。この治験のプロセスは、少数の健康成人を対象とした「第1相試験」、少数の患者さんを対象とした「第2相試験」、多数の患者さんを対象に既存薬と皮下を含めて大規模な試験を行う「第3相試験」に分けられます。
これらの試験全てに対して、良好な結果を示すことができた被験薬のみが、厚生労働省の外郭団体である医薬品医療機器総合機構において科学的な評価と書類の審査を受けることができ、そこで承認されてはじめて、新薬として市場に出荷されるのです。
新薬の営業
市場に出た新薬についての情報は、通常、MR(医薬情報担当者)やMS(医薬品卸)によって、医療機関や薬局に届けられます。新薬の対象疾患、効用、安全性、副作用は勿論のこと、使用限界量や適用除外の患者さんなどの情報も提供していきます。
また、新薬の効用や注意事項について医師からコメントをもらい、それを蓄積して社内の開発部門やMSにフィードバックします。と同時に、医療機関における研究会、医師向けの勉強会や講演会などを開催します。こうした様々な手段によって、新薬についての情報を関係各所に効果的に伝え、認知度を上げ、売れる医薬品に育て上げていくのです。
